突破性研究:TLS全景图谱助力癌症免疫治疗
AI导读:
科学家们利用高分辨率时空组学技术Stereo-seq,首次绘制出肝细胞癌中TLS的全景发育图谱,揭示TLS在调控抗肿瘤免疫中的独特特征,发现色氨酸代谢在TLS成熟过程中的关键调控作用,为癌症免疫治疗提供新方向。
在癌症面前,人体如何对抗?科学家们正致力于研究激活免疫系统的新方法,以期精准找到并消灭肿瘤。近期,一项突破性研究聚焦于肿瘤内的“免疫聚集体”——三级淋巴结构(TLS)。
这些“免疫枢纽”与患者接受免疫治疗后的积极反应紧密相关。TLS的存在通常预示着免疫治疗预后效果和临床结果更佳。然而,传统临床分类方法未能充分揭示TLS在空间分布和功能上的复杂差异。
近日,中山大学附属第一医院等多个团队联合利用华大自主研发的高分辨率时空组学技术Stereo-seq,首次绘制出肝细胞癌中TLS的全景发育图谱。该研究揭示了TLS在调控抗肿瘤免疫及免疫治疗反应中的独特特征,并发现了色氨酸代谢在TLS成熟过程中的关键调控作用,为肝细胞癌及其他癌症的早期诊断和新型免疫治疗方案提供重要参考。相关成果发表于《癌细胞》(Cancer Cell)。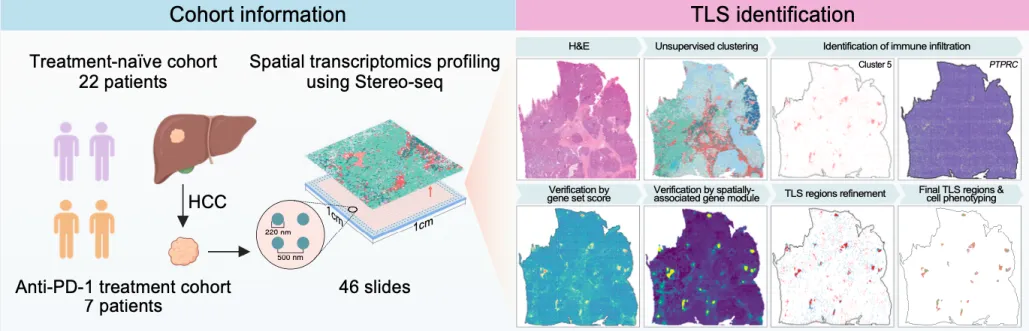
自主开发的TLS鉴定流程,在肝细胞癌组织中原位鉴定TLS(受访者供图)
时空组学技术助力TLS精准分类
研究团队在肝细胞癌患者样本中全面鉴定TLS,并精准注释,极大提升临床数据采集效率。通过集成自动化鉴定流程、TLS相关基因特征、空间共表达模式及免疫细胞簇聚类方法,团队识别出937个TLS,其中69个为成熟TLS。成熟TLS与多种实体瘤患者预后改善及免疫治疗疗效提升密切相关。
团队基于高分辨率空间细胞信息与分子信号,构建全新分类模型,将未成熟TLS细分为“趋向成熟型”和“偏离成熟型”。机器学习技术实现TLS状态精准区分。分析显示,“趋向成熟型”TLS中T细胞功能通路激活,与B细胞相互作用紧密,对调控免疫治疗反应关键。
发现关键调控因子,揭示免疫治疗协同机制
深入挖掘数据,团队发现肝癌细胞通过调控色氨酸代谢影响TLS成熟。高TDO2表达区域易形成“偏离成熟型”TLS。不同TLS类型中,B细胞色氨酸代谢活性差异明显,特别是在初始B细胞和生发中心B细胞中,“偏离成熟型”TLS色氨酸代谢活性显著富集。
小鼠肝细胞癌模型验证显示,低色氨酸饮食提升成熟TLS密度,改善肿瘤内代谢环境。低色氨酸饮食或TDO2抑制剂增加成熟TLS数量,与抗PD-1免疫治疗协同,有效缩小肿瘤。这些发现强调色氨酸代谢在TLS成熟及对免疫治疗反应中的关键作用。
文章通讯作者匡铭教授表示:“高分辨率空间组学技术为探索肿瘤免疫微环境提供新工具,揭示色氨酸代谢对TLS成熟的决定性影响,对肿瘤免疫治疗意义重大。”
共同第一作者白寅琪博士表示:“研究阐明TLS成熟与抗肿瘤免疫的内在联系,突显肿瘤微环境中代谢途径调控免疫细胞功能的关键作用,为解释免疫疗法反应差异提供新视角,指明癌症早期诊断、治疗反应预测和新型免疫治疗方案的新方向。”
(文章来源:读创)
郑重声明:以上内容与本站立场无关。本站发布此内容的目的在于传播更多信息,本站对其观点、判断保持中立,不保证该内容(包括但不限于文字、数据及图表)全部或者部分内容的准确性、真实性、完整性、有效性、及时性、原创性等。相关内容不对各位读者构成任何投资建议,据此操作,风险自担。股市有风险,投资需谨慎。如对该内容存在异议,或发现违法及不良信息,请发送邮件至yxiu_cn@foxmail.com,我们将安排核实处理。





